量子点(Quantum dots,QDs)特指半径小于或接近于(≲)其激子玻尔半径的准零维半导体荧光纳米晶体(粒径:1-20 nm),是20世纪七十年代发展起来的一类新型荧光标记物,具有非常独特的荧光性质。与传统的荧光蛋白及有机荧光染料相比,量子点具有以下显著优点:(1)荧光强度非常高,比荧光蛋白及有机荧光染料高了将近10-100倍,对提高检测灵敏度非常有利;(2)光稳定性好,约比荧光蛋白及有机荧光染料高100-1 000倍,非常适合于进行长时间实时监测;(3)激发光谱宽且发射光谱窄,加上源于量子尺寸效应的尺寸依赖发光特性,使其易于实现单色激发多色发射,有利于进行多色同时标记检测。因此,量子点在细胞生物学、生物化学、免疫学等学科领域被广泛地用于标记及成像。现有的传统金属化合物-元素有机物合成路线可以得到高质量的裸的半导体纳米晶体,但是,通常都采用了极其危险且昂贵的易燃易爆有毒的有机试剂如Cd(CH3)2、Zn(CH3)2等金属有机物剧毒、不稳定、易爆炸,并且需要在无水无氧的300℃高温下进行。即使这样,还难以同时满足既超小又结构完美并生物相容之苛求,所以,其综合性能往往不理想。
为解决高质量生物标记用荧光量子点的可控合成及其性能调节难题,课题组另辟蹊径,利用生物体系稳健精准的调控机制来解决量子点等标记物制备所涉及的化学反应过程精确控制难题。为此,提出“在时间和空间上耦合细胞内错综复杂而不能自然交会的生化反应途径可控合成纳米标记材料”的“时-空耦合调控活细胞合成策略”,巧妙地利用酵母细胞,仅仅通过简单的化学操作,控制胞内的不同生化反应向我们所期待的方向进行,实现了活细胞内不能自然发生的复杂合成反应,成功可控地合成出半导体多色荧光CdSe量子点。将通常油相化学合成CdSe约300°C的反应温度,降低到仅30°C(细胞培养温度),且不用任何易燃、易爆、有毒溶剂,将繁琐危险的化学操作演变为简单的细胞培养,并有效地将数分钟的快速合成过程减缓至几小时甚至几十小时的极慢过程,给予尺寸、性质等的调控以足够空间,可在活细胞中获得高质量的发光CdSe纳米晶体,并能方便可控地分别获得绿色、黄色、红色等粒径均一的荧光量子点【Adv. Funct. Mater., 19(2009)2359-2364; ACS Nano, 7(3)(2013)2240-2248; Small, 10(4)(2014)699-704】。
继而,又将该策略成功地从真菌体系(酵母细胞)扩展至细菌体系(金黄色葡萄球菌),实现了细菌细胞原位合成CdS0.5Se0.5发光量子点,高效地(几乎100%)将细菌细胞转变成“耀眼”的“信号灯”而实现细胞的“自”荧光功能化,产生“全同”发光细胞(细胞信标)作为荧光标记的示踪单元【ACS Nano, 8(5)(2014)5116-5124】。再利用金黄色葡萄球菌细胞壁表面天然表达的金黄色葡萄球菌A蛋白与抗体Fc端的特异性结合,通过改变不同抗体,即可方便高效构建出尺寸均一、单分散、荧光强、性能稳定、超灵敏的各种特异性荧光标记抗体探针,成功实现了对禽流感H9N2病毒、伪狂犬病毒、杆状病毒、鼠寒沙门氏菌、乳腺癌细胞等的高灵敏检测。
进一步地,又成功拓展至具有重大生物医学意义的哺乳动物细胞体系,如人乳腺癌细胞MCF-7、MDA-MB-231以及MDCK细胞等。同时,还通过精心设计,在时间和空间上耦合细胞的代谢和解毒途径以及细胞出芽产生微囊泡的过程,使得细胞按照设计思路完成了胞内荧光量子点合成并直接原位标记细胞源性微囊泡,实现了量子点活细胞合成与原位标记的融合,可直接收集到标记好的荧光微囊泡,方法温和高效,标记效率可高达94.8%【Sci. China Chem., 63(4)(2020)448-453】。工作意义不仅在于使细胞自动完成合成并标记,同时,也拓展了合成生物学的视界。
将量子点“活细胞合成”原理扩展至无细胞的模拟体系,提出了“准生物合成”新方法(JACS, 134(1)(2012)79-82; JACS, 138(6)(2016)1893-1903),解决了超小、生物相容(不含有毒重金属、可水分散、可经肾排出等)、多功能复杂结构、生物标记用荧光量子点水相合成的控制难题。
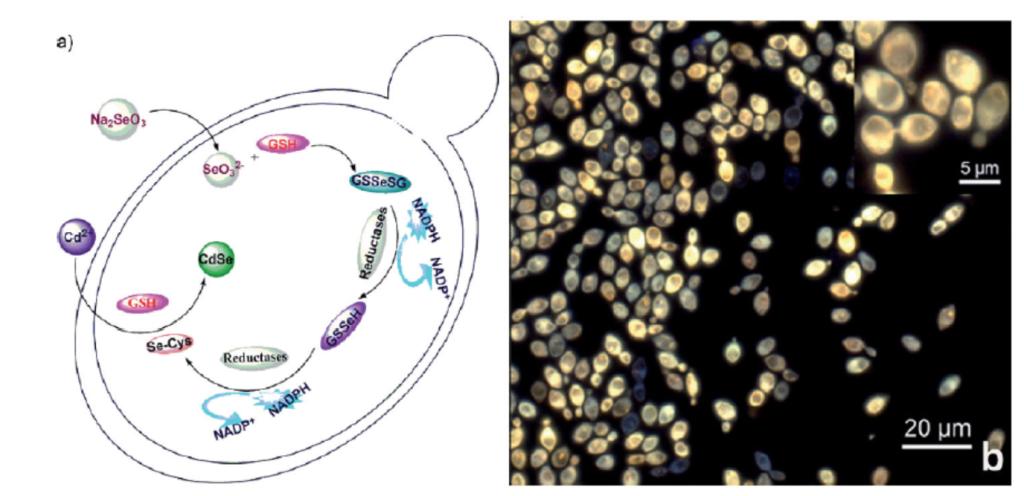
图. 荧光CdSe量子点的活细胞内生物合成路线图(a)和细胞内荧光的亚细胞定位图像(b)
附件下载: